Resumen Breve
Este video explica la Ley de Boyle, que describe la relación inversamente proporcional entre la presión y el volumen de un gas a temperatura constante. Se demuestra con un experimento sencillo y se aplican fórmulas para resolver problemas prácticos, enfatizando la importancia de mantener las unidades consistentes.
- La Ley de Boyle establece que a temperatura constante, el volumen de un gas es inversamente proporcional a su presión.
- Se explica cómo calcular cambios en presión y volumen utilizando la fórmula P1V1 = P2V2.
- Se resuelven dos problemas prácticos, destacando la importancia de identificar correctamente las condiciones iniciales y finales.
¿Cómo describir un gas?
Para describir un gas, es crucial considerar cuatro variables: presión, volumen, temperatura y la cantidad de moles. Sin embargo, trabajar con las cuatro variables simultáneamente puede ser complicado. La Ley de Boyle se enfoca en la relación entre la presión y el volumen, manteniendo la temperatura y la cantidad de gas constantes.
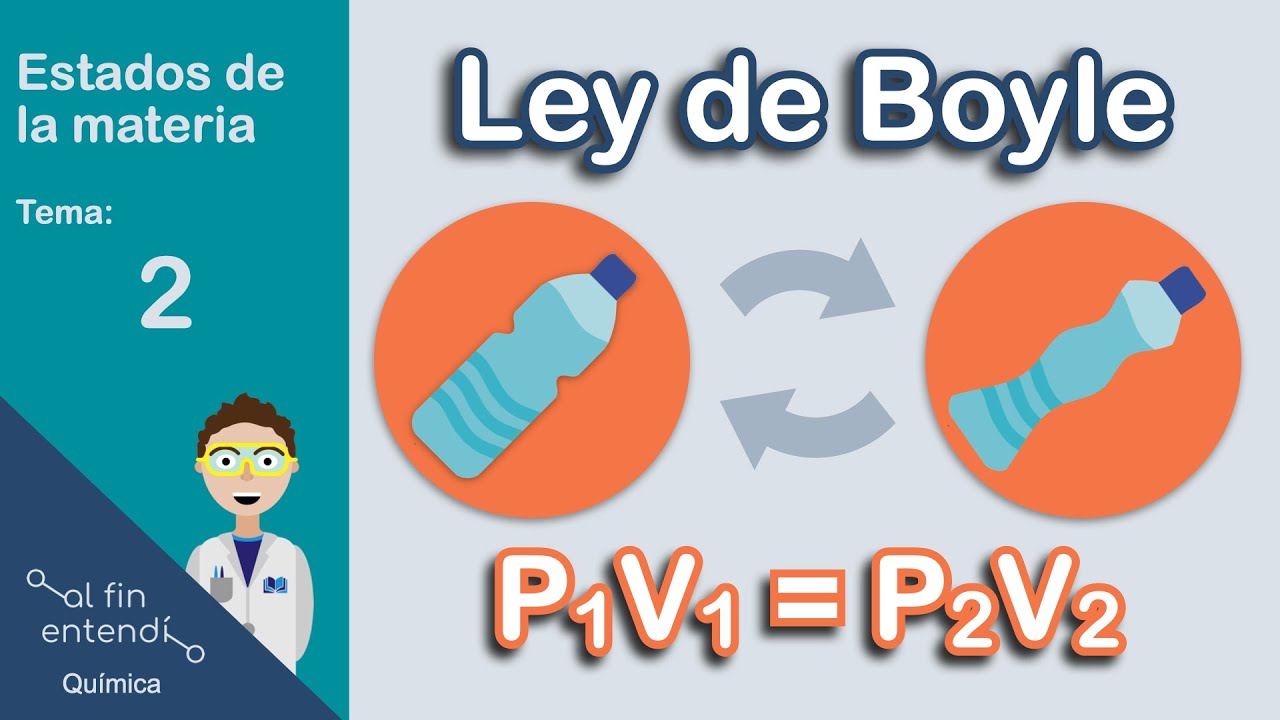
Ley de Boyle
La Ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Esto significa que si el volumen disminuye, la presión aumenta, y viceversa. La presión es el resultado de las colisiones de las moléculas del gas contra las paredes del recipiente. Al reducir el volumen, las moléculas chocan con mayor frecuencia contra las paredes, aumentando la presión. Matemáticamente, la ley se expresa como P1V1 = P2V2, donde P es la presión y V es el volumen. Para que esta ley se cumpla, la temperatura y la cantidad de gas deben permanecer constantes.
Problema 1
Se presenta un problema donde el aire en una botella de 400 ml tiene una presión de 0.8 atmósferas. Si el volumen se reduce a 160 ml a temperatura constante, se debe calcular la nueva presión. Primero, se identifican las condiciones iniciales (V1 = 400 ml, P1 = 0.8 atm) y finales (V2 = 160 ml, P2 = ?). Luego, se usa la fórmula de la Ley de Boyle (P1V1 = P2V2) para despejar P2, obteniendo P2 = (P1V1) / V2. Sustituyendo los valores, P2 = (0.8 atm * 400 ml) / 160 ml = 2 atmósferas. Este resultado es lógico, ya que al disminuir el volumen, la presión aumenta.
Problema 2
Se plantea un segundo problema: una muestra de nitrógeno gaseoso ocupa 12 litros a una presión de 790 mmHg. Se pregunta qué volumen ocupará a una presión de 654 mmHg, manteniendo la temperatura constante. Se identifican las condiciones iniciales (V1 = 12 litros, P1 = 790 mmHg) y finales (P2 = 654 mmHg, V2 = ?). Se despeja V2 de la fórmula de la Ley de Boyle, obteniendo V2 = (P1V1) / P2. Sustituyendo los valores, V2 = (790 mmHg * 12 litros) / 654 mmHg = 14.5 litros. Es crucial que las unidades sean consistentes en ambos lados de la ecuación para que se cancelen correctamente. Si se desea el resultado en otras unidades, se puede realizar un análisis dimensional.