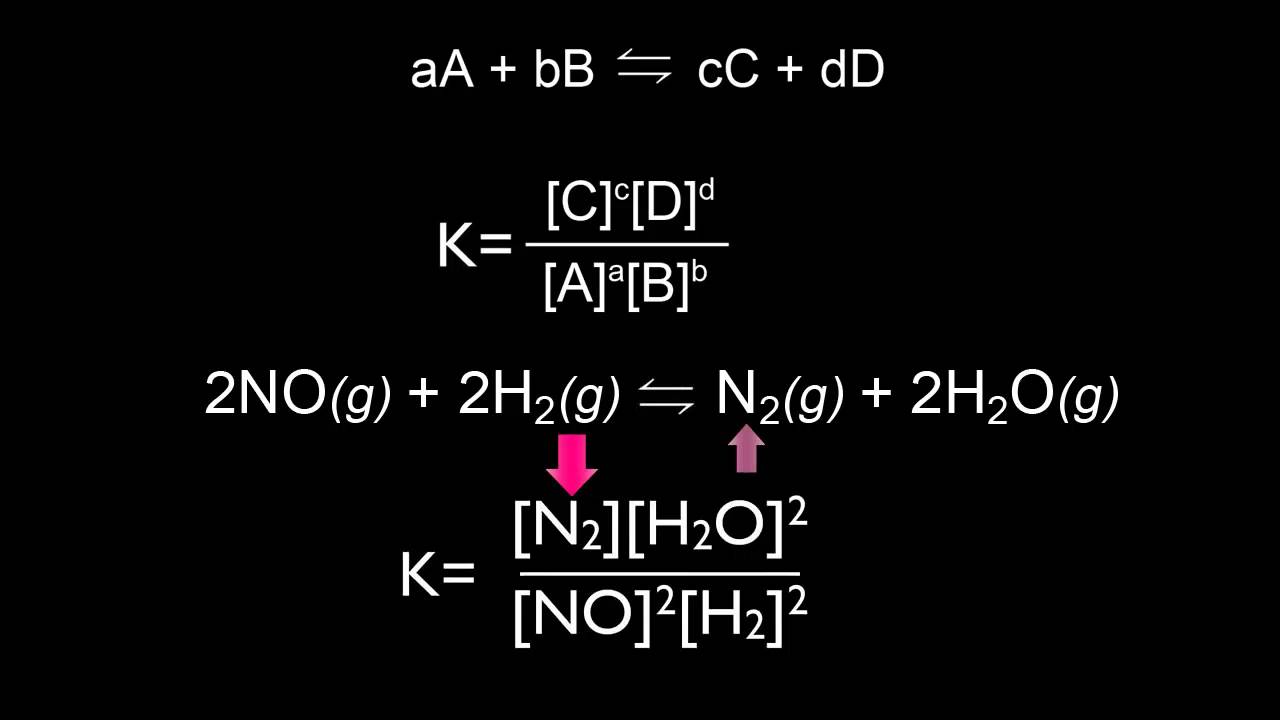Resumen Breve
Este video explica el equilibrio químico, un estado en el que la velocidad de la reacción directa es igual a la velocidad de la reacción inversa. Se introduce la constante de equilibrio (K) y el cociente de reacción (Q), mostrando cómo se calculan y cómo se utilizan para predecir la dirección en la que se desplazará una reacción para alcanzar el equilibrio. También se explica cómo construir y utilizar una tabla ICE (Inicial, Cambio, Equilibrio) para determinar las concentraciones de reactivos y productos en el equilibrio.
- El equilibrio químico se alcanza cuando las velocidades de las reacciones directa e inversa son iguales.
- La constante de equilibrio (K) y el cociente de reacción (Q) son herramientas clave para analizar y predecir el comportamiento de las reacciones en equilibrio.
- Las tablas ICE facilitan el cálculo de las concentraciones en el equilibrio.
Introducción al Equilibrio Químico
El video comienza con una demostración que ilustra el concepto de equilibrio químico mediante el trasvase de agua entre dos recipientes. Se explica que en una reacción reversible, los reactivos se transforman en productos y viceversa, hasta alcanzar un punto de equilibrio donde las velocidades de ambas reacciones se igualan. Se introduce la constante de equilibrio (K), que se define como la relación entre las concentraciones de los productos y los reactivos en el equilibrio.
Constante de Equilibrio (K) y Cociente de Reacción (Q)
Se explica que la constante de equilibrio (K) se utiliza para medir el estado de equilibrio, mientras que el cociente de reacción (Q) se calcula en cualquier punto de la reacción, incluso antes de alcanzar el equilibrio. Al comparar los valores de Q y K, se puede predecir la dirección en la que se desplazará la reacción para alcanzar el equilibrio. Si Q < K, la reacción se desplazará hacia los productos; si Q > K, se desplazará hacia los reactivos.
Cálculo de K y Q
Se muestra cómo calcular los valores de K y Q a partir de las concentraciones de reactivos y productos. Se explica que K permanece constante siempre y cuando la concentración de reactivos y productos no cambie, siempre y cuando se esté en equilibrio. Se utiliza una recta numérica para visualizar la relación entre Q y K y determinar la dirección en la que se desplazará la reacción.
Concentraciones y Equilibrio
Se analiza cómo las concentraciones de los compuestos cambian a medida que la reacción avanza hacia el equilibrio. Se muestra que, independientemente de las concentraciones iniciales, el sistema siempre alcanzará el equilibrio, donde las concentraciones se mantienen constantes.
Ecuación de la Constante de Equilibrio
Se explica la forma general de expresar la constante de equilibrio (K) en función de los coeficientes estequiométricos de la reacción. Se muestra cómo escribir la ecuación de K para diferentes reacciones, elevando las concentraciones de los productos y reactivos a las potencias de sus respectivos coeficientes.
Cálculo de K con Concentraciones Molares
Se demuestra cómo calcular el valor de K a partir de las concentraciones molares de los reactivos y productos en el equilibrio. Se sustituyen los valores en la ecuación de K y se simplifica para obtener el valor numérico de la constante.
Tabla ICE: Introducción
Se introduce la tabla ICE (Inicial, Cambio, Equilibrio) como una herramienta para organizar y calcular las concentraciones de reactivos y productos en el equilibrio. Se muestra cómo completar la tabla a partir de las concentraciones iniciales y los cambios en las concentraciones.
Uso de Q y K para Predecir la Dirección de la Reacción
Se explica cómo utilizar los valores de Q y K para determinar si una reacción se desplazará hacia la derecha (productos) o hacia la izquierda (reactivos). Se muestra cómo llenar el resto de la tabla ICE para conocer las concentraciones en el cambio, utilizando la estequiometría de la reacción.
Resolución de Problemas con la Tabla ICE
Se aborda un problema común en el que solo se dan las concentraciones iniciales, Q y K, y se debe descubrir el resto de la tabla ICE. Se explica cómo utilizar variables (como "x") para representar los cambios en las concentraciones y cómo resolver la ecuación resultante para determinar los valores de equilibrio. Se demuestra cómo simplificar la ecuación tomando la raíz cuadrada en ambos lados para facilitar el cálculo.